倫理審査申請について
はじめに
現在、人を対象とする疫学・臨床に関する研究は、「人を対象とする生命科学・医学系研究に関する倫理指針(令和3年文部科学省・厚生労働省・経済産業省告示第1号)」(令和5年3月一部改正)に基づいて行われることが求められており、近年では医学系雑誌への論文投稿、学会発表において、当該研究に対して必要な倫理審査が行われていることの証明が必須とされてきています。そのため、公益社団法人静岡県薬剤師会では研究倫理審査委員会にて倫理審査申請の受付をしております。
- 人を対象とする生命科学・医学系研究に関する倫理指針(令和5年3月27日一部改正)(PDF形式 689KB)
- 人を対象とする生命科学・医学系研究に関する倫理指針ガイダンス(令和6年4月1日)(PDF形式 1,420KB)
倫理審査が必要な研究
計画している研究が倫理審査を受ける必要があるか否かを倫理審査フローチャート(PDF形式 2,490KB)で確かめていただき、倫理審査が必要である場合は、研究責任者は倫理審査を受けてください(原則として研究を行う前)。
倫理審査を受ける前に
本会が行う倫理審査に申請するためには、研究責任者が申請時において、研究倫理に関する教育プログラムを修了していることが申請要件です。
修了していない方は「JPALS(日本薬剤師会生涯学習支援システム)」、または「ICRweb」、「APRIN eラーニングプログラム(CITI Japan)」などを受講・修了してください。
※受講を証明できる書類(修了証など1枚で可)の写が申請に必要です。
※修了日から起算して倫理審査委員会の開催予定日までの期間が1年を超えている場合は、再受講が必要となりますのでご注意ください。
倫理審査スケジュール
倫理審査委員会は原則として年4回開催します。
開催月は5月、8月、11月、2月(申請書類の提出締め切りはそれぞれ3月、6月、9月、12月の末日)です。
倫理審査申請の流れ
申請から結果報告までの流れ
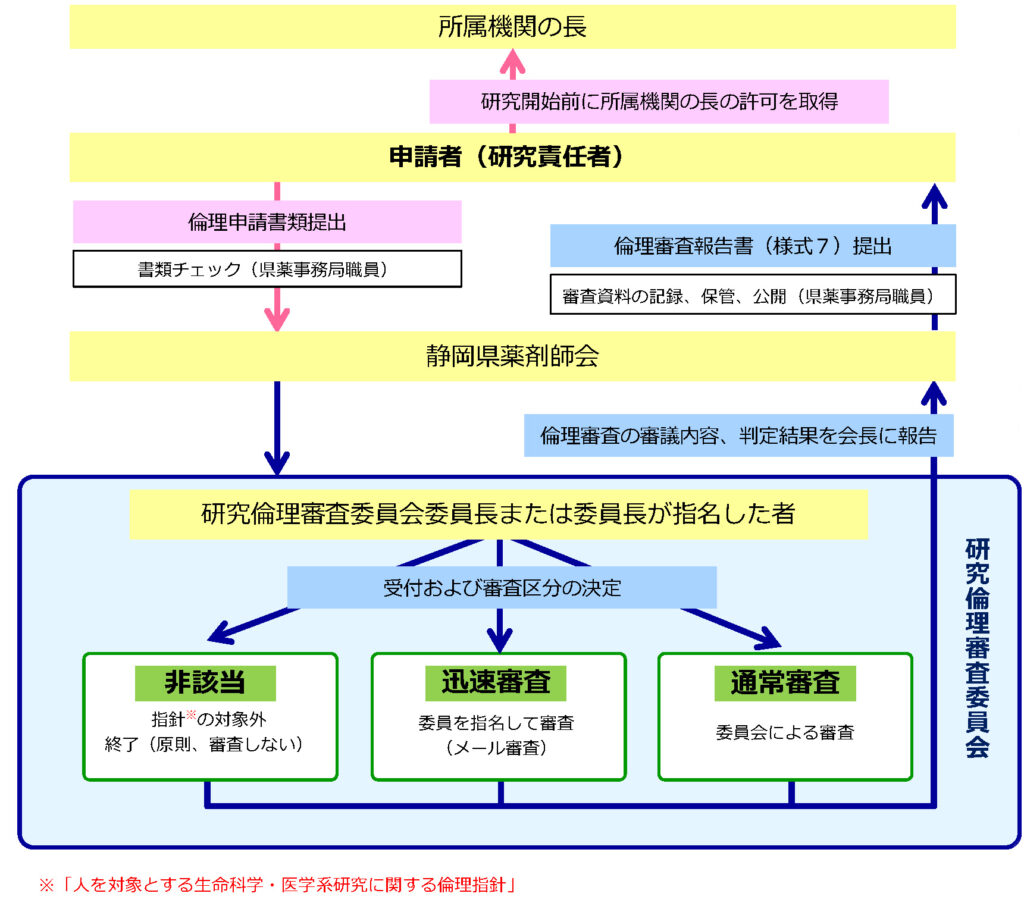
1 倫理審査申請
申請を希望される方は、「人を対象とする生命科学・医学系研究の実施に関する手順書」及び「倫理審査申請の手引き」をご確認いただき、必要な書類を郵送で申請してください。
2 倫理審査受付、ヒアリング
事務局から必要に応じて、提出された申請書類に関するヒアリング、修正依頼等をいたします。
3 研究倫理審査委員会への出席
研究倫理審査委員会(開催日)には研究責任者の出席が必要です。開催日時は事務局から連絡します。
4 審査結果通知
研究倫理審査委員会終了後、2週間を目途に審査結果を通知いたします。
なお、審査方法が迅速審査となった場合には、審査結果がまとまり次第審査結果を通知いたします。
※「修正した上で承認」となった場合には、問題点を解消した修正書類を研究倫理審査委員会に提出してください。確認後の承認となります。
5 研究開始
研究計画書に則って研究を実施してください。
有害事象が発生した場合は、その内容を報告してください。
※研究計画書を変更する場合は、事前に倫理審査申請書(様式1)の「変更」欄にチェックを入れ、倫理審査委員会に計画の変更を申請してください。
6 報告書の提出
・研究責任者は、年1回(毎年3月)、実施している臨床研究の研究等実施状況報告書(様式7)を所属機関の長並びに本会研究倫理審査委員会に提出してください。
・研究責任者は、当該研究が終了した場合、あるいは、何らかの理由で研究を終了したときは、遅滞なく、研究終了(中止)報告書(様式8)を所属機関の長並びに本会研究倫理審査委員会に提出してください。
※研究終了後3か月以内が目安です。
・所属機関の長は、研究の適正性・信頼性・継続性に影響を与える事実を把握した場合は、必要に応じて当該研究題名、逸脱の内容、逸脱した理由を記載した研究計画に関する逸脱等報告書(任意様式)を、本会研究倫理審査委員会に提出してください。
規程・手順書等 (2024年7月11日改訂版)
公益社団法人静岡県薬剤師会研究倫理審査委員会設置規程(PDF形式81.5KB)
人を対象とする生命科学・医学系研究の実施に関する手順書(PDF形式128KB)
人を対象とする生命科学・医学系研究の倫理審査業務手順書(PDF形式185KB)
公益社団法人静岡県薬剤師会における学術研究に係る利益相反規程(PDF形式86.5KB)
倫理審査申請の手引き(PDF形式191KB)
倫理審査フローチャート(PDF形式131KB)
申請に必要な書類 (2024年7月11日改訂版)
2 研究計画書(所定の記載項目、記載例あり。)
3 説明文書(記載例あり)
4 同意文書(記載例あり)
5 同意撤回文書(記載例あり)
〇研究計画書記載例(アンケート調査 1機関)(日本薬剤師会作成)(WORD形式63KB)
〇研究計画書記載例(アンケート調査 3機関)(日本薬剤師会作成)(WORD形式86KB)
〇研究計画書記載例(侵襲なし・介入なし)(日本薬剤師会作成)(WORD形式84KB)
〇研究計画書記載例(軽微な侵襲あり・介入あり)(日本薬剤師会作成)(WORD形式160KB)
7 研究責任者の経歴書(様式3)(WORD形式24.4KB)
8 倫理審査申請チェックリスト(様式4)(WORD形式31.5KB)
9 研究倫理に関する研修修了証の写
10 申請料の振替払込請求書兼受領証の写
結果の通知 (2024年7月11日改訂版)
研究開始後の報告 (2024年7月11日改訂版)
・研究計画に関する逸脱等報告書(任意様式)
申請費用のお支払い方法
最寄りの郵便局の「払込取扱票」に必要事項を記入の上、ATMまたは窓口へ申請費用を添えてお振込ください。
■必要記入事項
・口座記号:00870-4
・口座番号:84504
・加入者名:公益社団法人静岡県薬剤師会
・通信欄への記載事項:
1. 倫理審査申請費用
2. ご住所、ご氏名
3. 静岡県薬剤師会会員・非会員の別、所属地域・職域薬剤師会名
■申請費用
研究責任者が静岡県薬剤師会の会員である場合:1件10,000円
非会員である場合:1件30,000円
■ご留意いただきたいこと
・振込手数料は申請者のご負担とさせていただきます。
・審査を申請した研究が、いかなる判断になった場合(却下、保留、倫理審査不要など)でも、申請費用の返金はいたしませんのでご了承ください。
申請書類の郵送先
〒422-8063 静岡市駿河区馬淵2丁目16番32号 静岡県薬剤師会館
公益社団法人静岡県薬剤師会あて
封筒に「倫理審査書類在中」と赤ペン(朱書き)でご記入ください。
参考リンク
研究倫理/日本薬剤師会ホームページ
日本薬剤師会臨床・疫学研究推進委員会「研究倫理審査申請準備ガイド ~研究計画書の記載方法~」
問合せ先
gakujutsu@shizuyaku.or.jp
※このアドレスはお問い合わせ専用であり、メールでの倫理審査申請はできません。
※回答までに時間を要する場合もあります。
